2014년 오페브와 에스브리어트가 FDA의 승인을 얻은 후 100 건이 넘는 IPF 임상이 있었으나 모두 실패한 바, 대부분이 주로 지속적인 염증으로 TGF-ß나 성장인자에 의한 섬유아세포의 과도한 증식과 분화가 섬유화의 원인이라는 가설에 기초하여 TGF-ß나 성장인자의 특정한 섬유화 신호전달경로의 차단을 타켓으로 하고 있어 효과가 제한적인 반면 부작용의 소지가 커 새로운 항섬유화제의 개발을 위해 패러다임의 전환이 필요한 상황입니다.
이를 위하여 연구팀은 기존의 패러다임에서 벗어나 우선 정상인과 IPF 환자의 세포 내 차이를 탐색하는 작업에서 출발하여 IPF 환자의 HIF-1α, NOX4 및 ROS의 레벨이 정상인에 비해 2배 가량 높은 것에 주목하고 새로운 항섬유화제의 개발을 위해서는 특정한 섬유화 신호전달경로의 차단보다는 상승되어 있는 섬유화 미세환경(Fibrotic Micro-environment)의 조절을 타켓으로 하는 새로운 접근방법이 보다 효과적이라고 판단하고 있습니다.
-
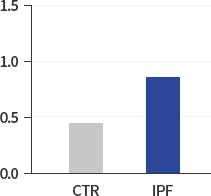
HIF-1α/β:ACTIN
-
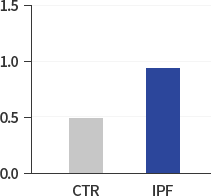
NOX4:GAPDH
(densitometric analysis) -
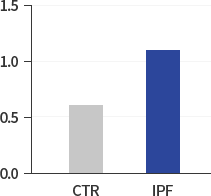
Superoxide O2-
(nMol/100.000Cells)
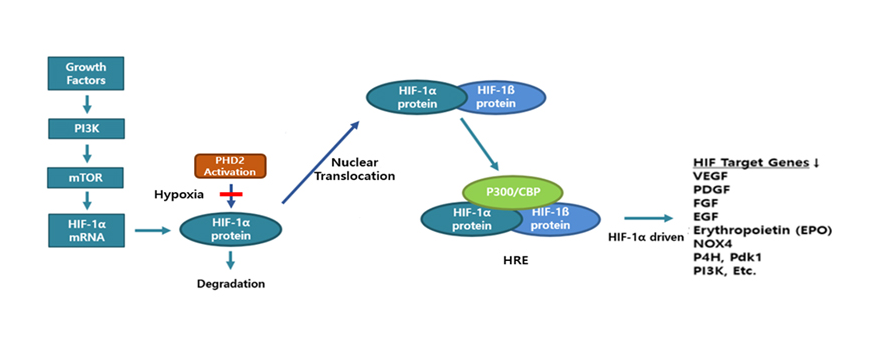
특히 저산소(Hypoxia)에서 HIF-1α의 활성으로 HIF-1α의 표적유전자인 NOX4가 증폭 발현되고 과도한 ROS(H2O2)가 생성되어 저산소를 심화시키는 동시에
섬유화 신호전달을 유도하므로 HIF-1α의 억제를 통하여 섬유화를 차단할 수 있다고 보고 아래와 같이 실험을 통하여 이를 확인한 후 HIF-1α의 억제를 타켓으로 설정하였습니다.
이에 따르면 초기에는 염증에 의한 섬유화(Inflammation Derived Fibrosis)가 진행되지만 어느 정도 섬유화가 진행되면 즉 IPF 환자가 되면 암의 경우와 같이 저산소에 의해 섬유화가 스스로 섬유화(Hypoxia Derived Fibrosis)를 유발하게 되며 그 중심에는 HIF-1α가 있게 됩니다.
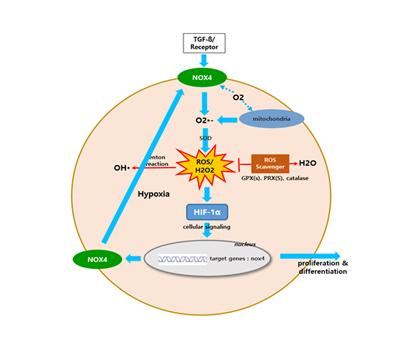
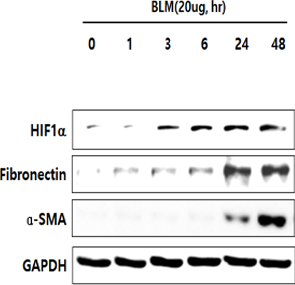
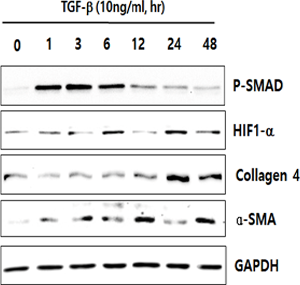
섬유화 유도인자인 TGF-β와 bleomycin을 세포에 처리하면 초기에 HIF-1α가 증가하고 뒤이어 fibrosis marker인 a-SMA, fibronectin, collagen이 증가
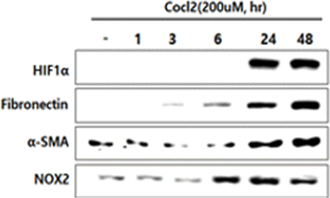
HIF-1α의 분해를 억제하여 세포 내 HIF-1α의 농도를 증가시키는 CoCl2를 처리하면 fibrosis marker가 증가
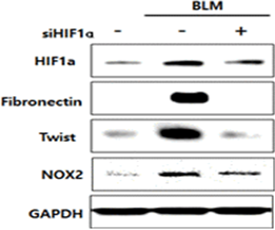
Antisense DNA를 이용 인위적으로 HIF-1α의 농도를 감소하면 bleomycin에 의하여 유도된 fibrosis marker도 현저히 감소